SERVICE PHONE
363050.com发布时间:2025-09-09 07:07:05 点击量:
PG电子,PG电子官网,PG电子老虎机,PG电子APP,PG电子试玩,PG电子注册/PG电子(Pocket Games)亚洲顶级电子游艺品牌,热门老虎机、爆款游戏全覆盖,提供官方正版APP下载、免费试玩及丰厚奖金。立即加入PG电子,畅享高返奖率与刺激体验!【2025年8月8日更新:值医咖会9周年之际,赶快去医咖会APP限时领取基础会员权益,含28张基础课程券,各种科研课程随心看】
2025年7月,《Nature Medicine》发表了一篇研究[1],研究利用500多万人的基因数据,开发了BMI相关的多基因评分(PGS),研究表明,PGS评分可预测整个生命周期的成年肥胖风险,尤其在生命早期阶段和重度肥胖方面。

肥胖是全球重大公共卫生问题,预计到2035年影响超半数人口。研究表明肥胖多始于童年并持续存在,因此早期预测指标具有重要价值。PGS能评估遗传易感性,但现有评分解释能力有限,且跨人群适用性弱。
本研究通过最大的BMI GWAS Meta分析(使用了人体性状遗传研究协会[GIANT])和基因检测公司[23andMe]数据)的结果,推导针对BMI和肥胖的特定血统及多血统PGS,以检验其在不同成人、儿童和青少年、强化生活方式干预的减重背景下的表现。
前瞻性队列研究,2006-2010年在英国招募了50万40-69岁的参与者。
美国事务部医疗中心自2011年已招募超过100万名参与者,PGS使用其第三批基因组数据(R3)。
与电子健康记录关联的生物样本库,参与者血统背景和文化高度多样化,非选择性招募来自纽约市西奈山医疗系统的各类人群。
基于人群的开放队列研究,由英国医学研究委员会与乌干达病毒研究所建立。本研究纳入年龄≥18岁、已完成全基因组基因分型或全基因组测序的个体。
一项始于1991年的英国前瞻性出生队列研究,招募了超过1.4万名孕妇,对其子女进行了从出生至今的长期随访。
美国多中心随机对照试验(1993-2001年),旨在评估不同癌症筛查方案的效果。本研究利用了其基线问卷中参与者自我报告的20岁和50岁时体重与BMI数据。
美国27个中心开展的随机对照试验,旨在比较不同措施预防高危糖尿病前期人群进展为2型糖尿病(T2D)的效果。本研究使用已进行基因分型的白种人、黑种人和西班牙裔参与者,并排除了药物干预组。
:美国16个中心进行的随机对照试验,旨在评估强化生活干预对超重/肥胖T2D患者心血管疾病发病率和死亡率的影响。本研究仅分析了自我报告为非裔/黑种人、西班牙裔和白种人且已进行基因分型的参与者。
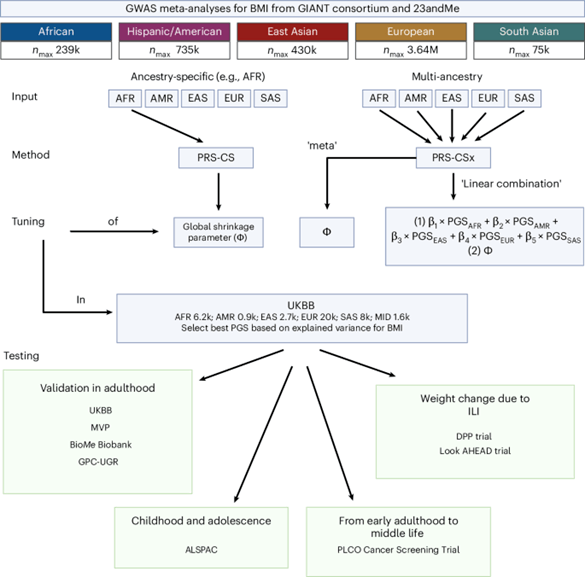
将BMI GWAS Meta分析作为PGS的训练数据。PGS的推导中,使用了特定血统评分PRS-CS及多血统评分PRS-CSx。PRS-CS(x)采用贝叶斯回归框架,并对单核苷酸多态性(SNP)效应假设了连续收缩先验。PRS-CS仅依据限定人群GWAS摘要统计数据和连锁不平衡(LD)信息;而PRS-CSx通过共享先验跨人群耦合SNP效应,群体特异的等位基因频率与连锁不平衡(LD)模式,最终构建多血统评分。
:BMI解释方差外,按人群分层计算多项整体性能和区分度指标:Nagelkerke R²、BMI的平均差异、比值比(OR)、AUC(曲线下面积)。还对UKB参与者中,按年龄和性别分层单独计算了BMI的解释方差。
:在ALSPAC研究中,可获得从出生到24岁的重复人体测量数据。评估了标准化PGS
,以检验PGS(10%、80%、10%)与4个月至24岁间未经转换的BMI和身高变化之间的关联。
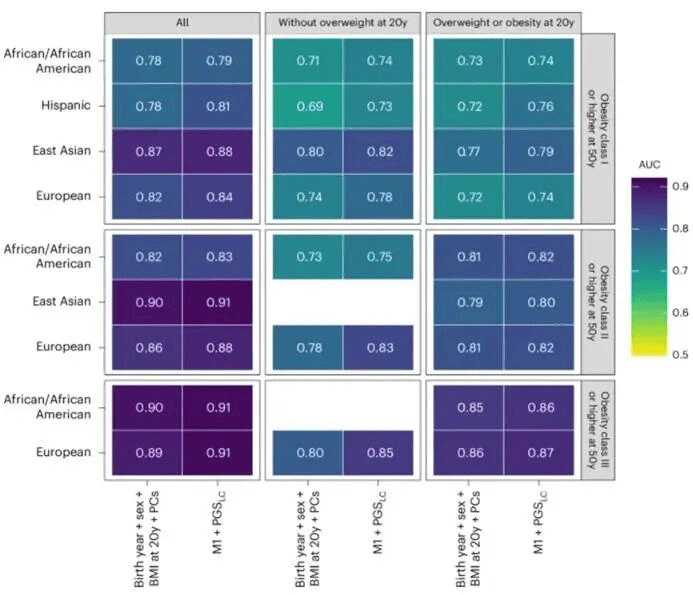
在PLCO研究中,研究评估了PGSLC与20岁至50岁间每5年体重和BMI变化之间的关联,按人群和性别分层。研究计算了PGS对50岁时肥胖结局的按人群分层的AUC。
研究使用200多项BMI GWAS Meta分析数据,纳入了510多万不同人群的个体。研究人群分类:欧洲类似血统(EUR)、东亚类似血统(EAS)、美洲类似血统(AMR)、非洲类似血统(AFR)和南亚类似血统(SAS)。
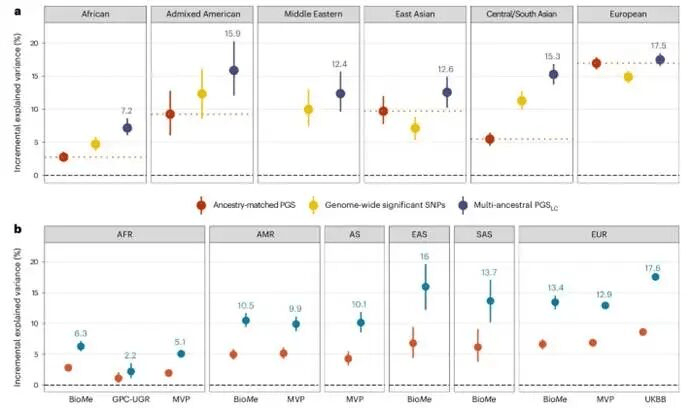
在UKB中完成参数调优后,研究使用PGSLC验证独立人群,评估了UKB、MVP、BioMe、GPC-UGR的482,135名参与者。肥胖患病率在不同人群和队列间差异显著。
PGSLC在UKB的EUR个体中表现最佳,解释方差为17.6%。在AFR占比较高的人群中,其性能显著较低。总体而言,在验证人群中观察到的解释方差中位数为10.3%。
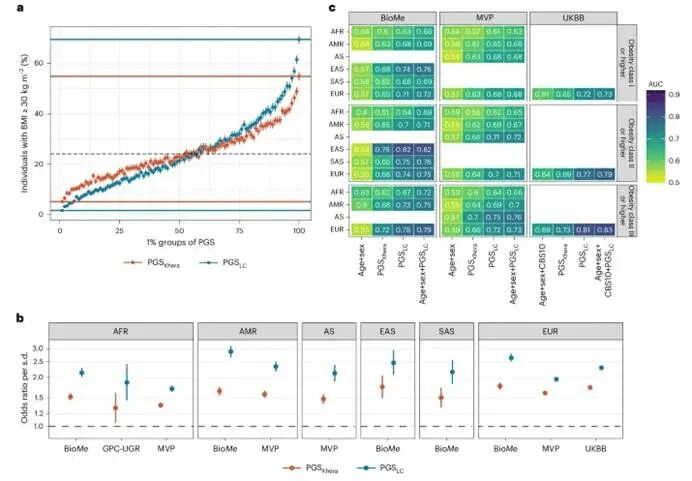
研究评估了PGS对肥胖的整体预测性能和区分能力。在EUR人群中,与PGS-Khera相比,PGSLC展现出更强的能力来区分肥胖(BMI≥30 kg/m²)。在PGSLC评分最高的1%人群中,肥胖患病率为69.5%,而PGS-Khera为54.9%(图3a)。跨人群分析显示,PGSLC每增加一个标准差,与≥I级肥胖的OR中位数增加1.9至2.6倍相关(图3b)。AUC同样随肥胖严重程度增加而上升,在多个人群中重度肥胖AUC接近0.80(图3c)。
研究在ALSPAC中探讨了PGSLC在儿童早期的预测价值。重复横断面分析显示,PGSLC与BMI的关联在出生后不久的效力较小,但在儿童早期显著增强:从12月龄时每标准差PGSLC对应0.12个标准差的BMI,到12岁时增至近四倍(每标准差PGSLC对应0.45个标准差),此后效应趋于平稳(图4a)。PGS也与身高存在关联,但效力较弱:在儿童早期逐渐增强,至12岁时达到峰值,随后在青春期中期回落至零。这表明,生命早期较高的BMI遗传易感性会普遍促进体格增大,但不会延续至青春期后的身高。
具有较高遗传易感性(PGS ≥10%)的儿童,其BMI随时间增长速度比较低遗传易感性的儿童更快,2.5岁后最为明显(图4b)。
与可测量的预测指标(出生体重、母亲教育水平、孕前母亲BMI、母亲分娩年龄和家庭社会地位)相比,PGS与其结合,可使总解释方差大致翻倍:8岁时从11%增至21%,15岁时从13%增至26%(图4c左)。
在预测成年早期BMI时,与BMI相比,年龄较小的时候加入PGS更具价值:从5岁时的1.5倍(从22%增至35%)到1岁时的超过三倍(从8%增至26%)(图4c右)。
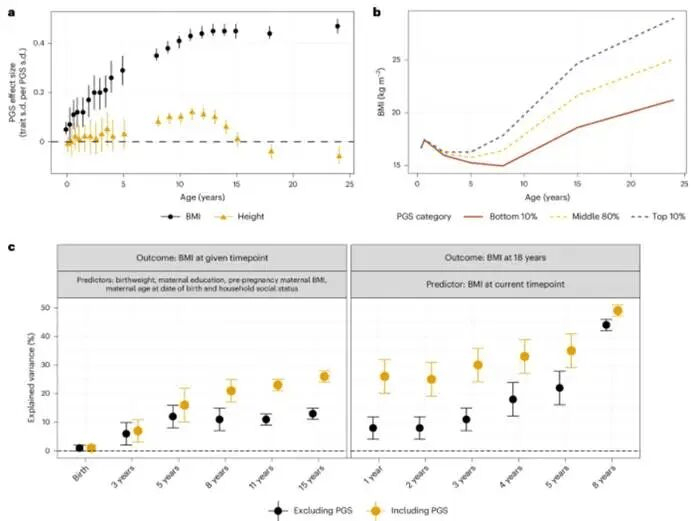
图4.儿童和青少年时期PGSLC的预测能力,a,PGSLC与BMI及身高的重复横断面线性回归关联结果;b,线性样条多水平模型绘制的从4月龄至24岁的平均BMI轨迹序列(调整性别和遗传主成分);c,PGSLC对BMI(按性别和时间点进行基于排名的逆正态转换)解释方差的贡献。
PLCO中,PGS较高的男性和女性,在20岁至50岁期间的体重和BMI(自我报告)变化更大。跨人群分析显示,PGSLC每增加一个标准差,对应的每5年变化在女性中始终高于男性。
在已有出生年份、性别和20岁时BMI的预测模型中加入PGS,对50岁时肥胖的预测区分能力仅有小幅提升。对于20岁时无超重/肥胖的群体,PGS的增量预测价值更高(增量AUC范围0.02–0.05),且未发现明显的性别特异性差异。
在DPP和Look AHEAD中进行分析。在3,909名参与者中,调整初始体重后发现,相较于对照组,PGSLC较高的个体强化生活干预的第一年内减重更多(每PGS标准差减重增加0.55kg,95% CI:-0.94至-0.16)。第一年内体重减少≥3%的参与者中,较高的PGS与后续数年(最多3年)内更明显的体重反弹相关(每PGS标准差体重多回升0.48kg,95% CI:0.00至0.95)。
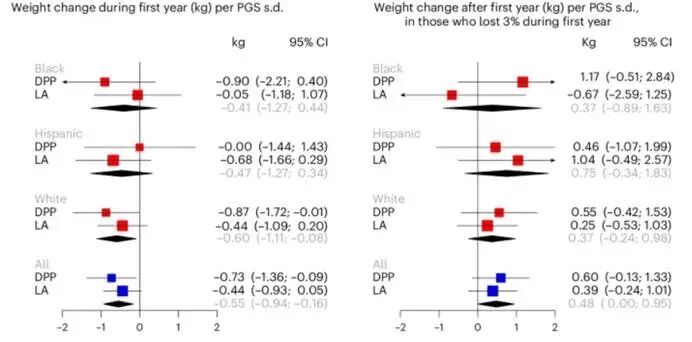
图6.在使用生活干预且有减重效果的个体中,PGSLC对其减重情况的影响
研究利用来自GIANT和23andMe的GWAS摘要统计数据(涵盖超过510万人),基于特定血统评分PRS-CS及多血统评分PRS-CSx开发了PGS,用于捕捉体重增加和肥胖的遗传易感性。
与PGS-Khera相比,总样本量增加15倍导致预测准确性提高2-3倍。但PGS在AFR人群中评估性能较差,可能是因为训练集中非洲样血统个体的代表性不足,以及次要等位基因频率和LD模式的差异。
遗传效应随年龄增长显著增强,并在儿童期和青春期表现为明显的BMI轨迹分化。因此,在出生时临床预测指标的基础上加入PGS,在预测5岁后BMI值时表现出了更高的价值。研究结果与生命早期遗传变异与肥胖之间动态关系的研究一致。
在PLCO研究中,较高的PGS与从成年早期到中年30年期间的体重增长相关。如果成年早期BMI低于其遗传预测水平,之后可能有潜在的发展为其遗传倾向的体重增长风险。
PGS较高的肥胖/超重个体强化生活干预第一年减重较多,但其反弹风险也更高。关于遗传因素如何影响减肥干预效果的研究证据仍相对匮乏且结论不一致。这种不确定性源于研究中的遗传变异类型、研究方法及实验设计的差异,充分表明了减重干预对高效能PGS的需求。
研究表明,BMI的PGS评分可用于预测整个生命周期的成年肥胖风险,尤其在生命早期阶段和重度肥胖方面。
